从污泥-秸秆联合厌氧污泥体系中富集出以BaP为唯一碳源的菌群——YQ-BaP菌群,通过单因素实验研究了不同环境因素对菌群降解能力的影响,采用GC-MS分析苯并[a]芘降解的中间代谢产物。结果表明:该菌群优势菌属为Pseudomonas和Methyloversatilis。该菌群在培养14d后对30mg/L BaP的降解率稳定在38.69%±6.24%,对菲和芘的降解效果更佳。YQ-BaP 菌群在pH=7和35~40℃时表现出较强的降解能力;当BaP初始浓度为20mg/L时,对BaP降解率达到46.89%。GC-MS分析表明,BaP在降解过程中产生菲、蒽和萘等羟化和甲基化代谢产物。研究显示,该菌群具有较强的BaP降解能力,可为多环芳烃污染环境的生物修复提供理论基础和技术支撑。
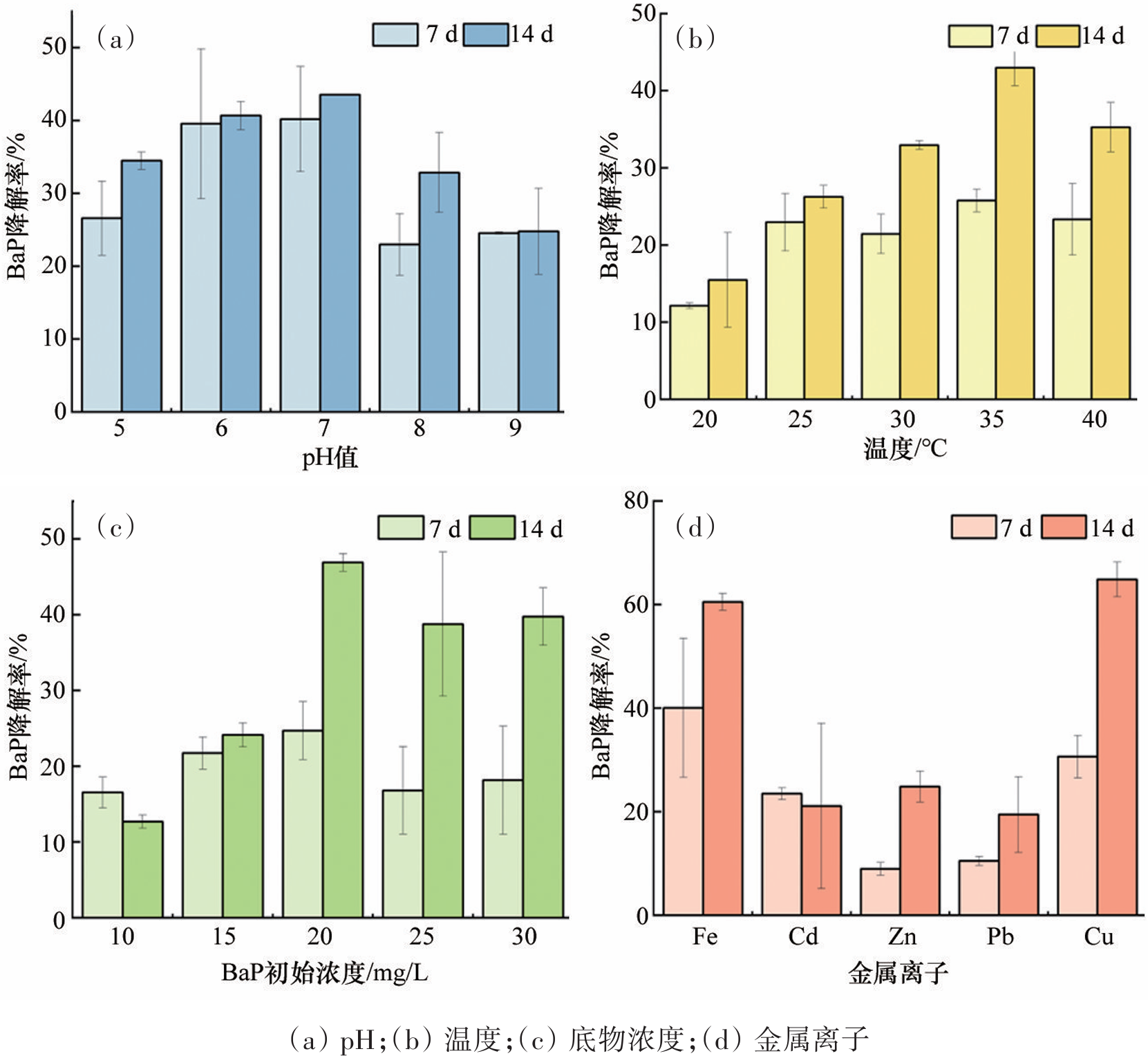
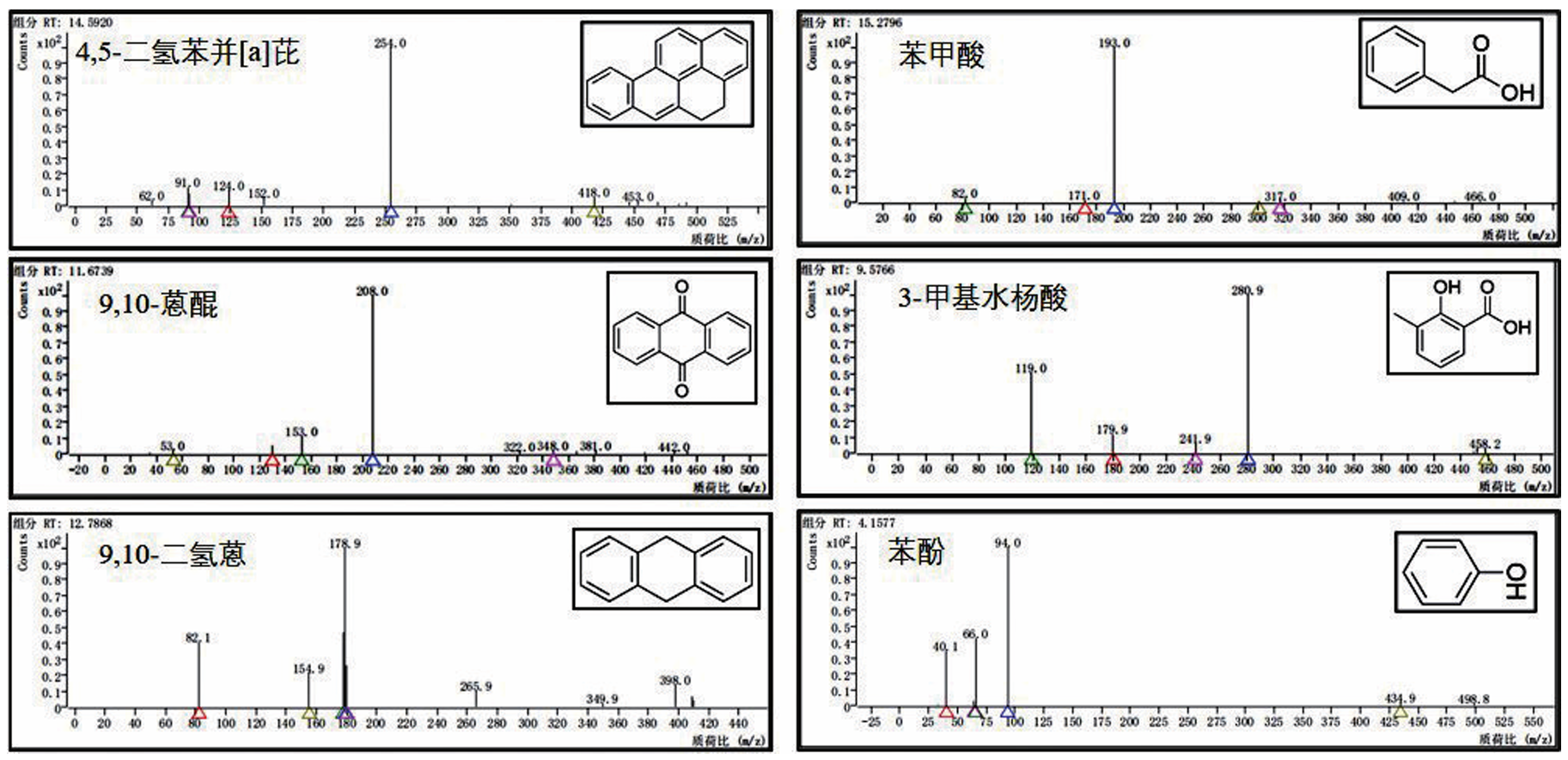
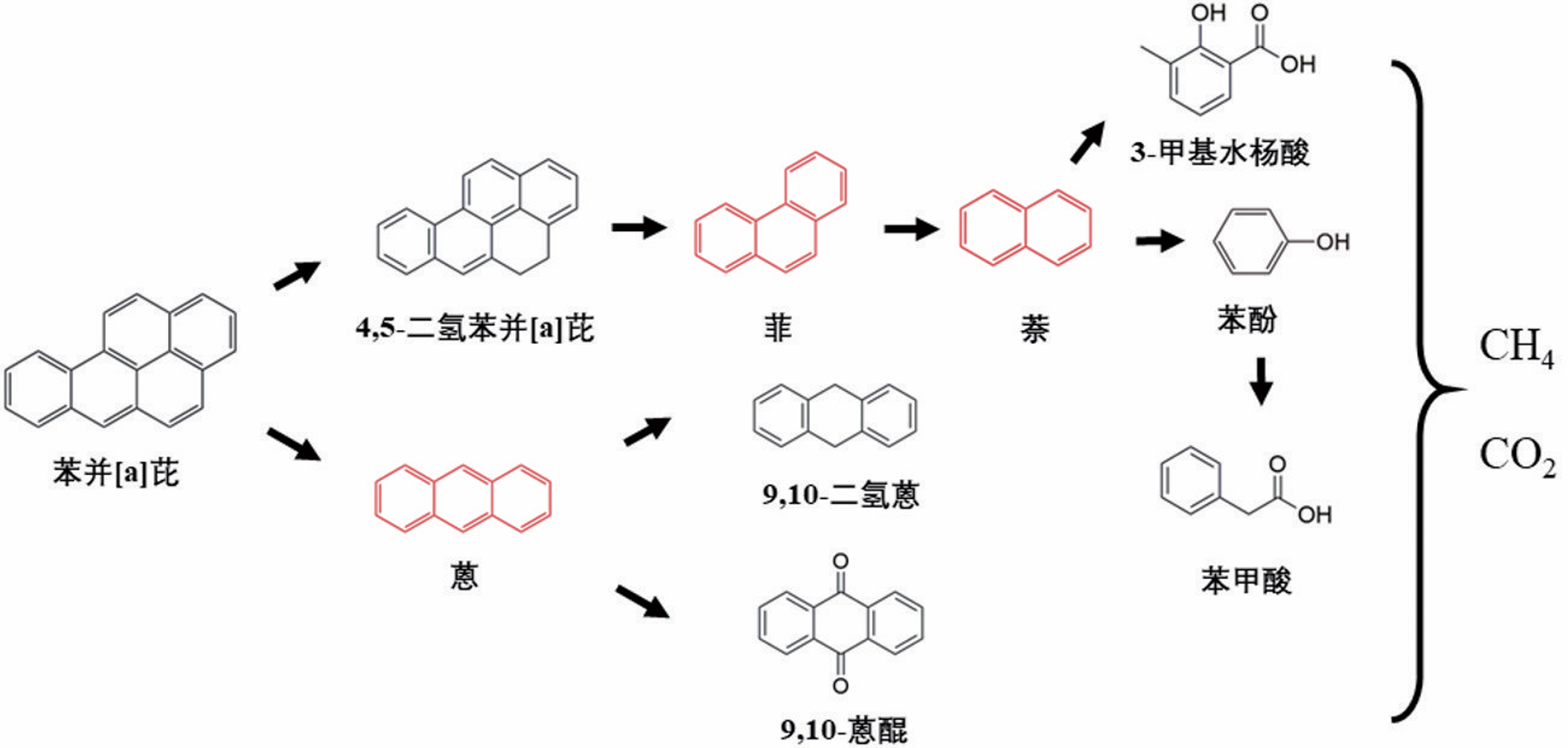
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是指分子中含有不少于两个苯环,以角状、线状或簇状等方式排列组合构成具有“三致”效应的持久性有机化合物。随着分子结构中苯环数量的增加,PAHs的疏水性、稳定性和毒性增强。作为高分子量PAHs的典型代表,苯并[a]芘具有强疏水性和低水溶性,易在沉积物、土壤和污泥等环境介质中吸附或富集。Shi等发现渭河干流及其支流沉积物中PAHs总致癌性最高可达到138.84mg/kg,其中苯并[a]芘对毒性当量的贡献占44.6%。苯并[a]芘在焦化厂土壤中浓度为110±18.0mg/kg,污染深度高达10m以上,在北京、广州和上海等城市土壤中也发现不同程度的PAHs污染。城市污水处理厂污泥的多环芳烃毒性风险研究中发现苯并[a]芘和二苯并蒽毒性当量最高。由于苯并[a]芘对人类健康和生态系统构成危害,开展苯并[a]芘污染的治理技术研究具有重要意义。 PAHs污染环境的生物修复具有效果好、成本低和无二次污染等特点,是目前最具潜力的PAHs污染治理技术之一。PAHs在好氧环境中易降解,并从中分离富集出诸多好氧降解菌,包括芽孢杆菌、莫拉氏菌、克雷伯氏菌和不动杆菌等。PAHs好氧降解的代谢途径研究较成熟,PAHs通过双加氧酶加氧和脱氢反应生成对应的芳香族二羟基化合物,随后氧化裂解成可生物利用化合物,最后彻底降解。但在厌氧条件下,因微生物代谢缓慢以及缺少氧气作为电子受体使PAHs厌氧降解途径鲜有报道,针对高分子量多环芳烃的厌氧降解过程更是知之甚少。Liang等分离出的假单胞菌JP1在硝酸盐还原条件下可降解菲、荧蒽和苯并[a]芘,培养40d后对10mg/L苯并[a]芘的降解率为30%;而白腐真菌Schizophyllium commune20R-7-F01在培养10d后对50mg/L苯并[a]芘的降解率仅为13.1%。Qin等利用Microbacterium sp.菌株证实了苯并[a]芘的降解过程遵循渐式开环模式。此外,有报道指出苯并[a]芘厌氧生物降解的初始化过程为甲基化或者羧基化,目前关于苯并[a]芘厌氧生物降解途径并未明晰,仅其少数中间代谢产物被证实,例如:二氢苯并[a]芘、芘、菲、萘和蒽等。现有研究主要集中在筛选分离出单菌株降解BaP的代谢产物,有关功能混合菌群降解BaP的化学途径却鲜有报道。此外,环境中多环芳烃降解微生物无法全部进行分离纯化培养且单一菌株对环境要求苛刻,因此可利用宏基因组学来确定富集所得菌群的多样性和功能。目前,关于BaP厌氧降解的研究主要集中于河流沉积物、地下水、深层土壤和海洋沉积物,而对于城市污泥厌氧消化这类典型厌氧环境中多环芳烃生物降解研究较为缺乏,且体系中降解机理研究不够深入。 本研究从污泥-秸秆联合厌氧消化体系中富集出BaP厌氧降解菌群,对降解条件及其性能进行优化研究;采用GC-MS分析鉴别出BaP厌氧降解代谢产物。 1 材料与方法 1.1 培养基 基础培养基:NH4Cl 1.2g、K2HPO4 0.27g、KH2PO4 0.35g、去离子水1 L。 无机盐离子培养基:CaCl2·2H2O 0.1g、MgCl2 0.1g、FeCl2·4H2O 0.02g、Na2S 0.005g、刃天青0.001g、去离子水1L。 微量元素培养基:ZnSO4·7H2O 40mg、MnSO4·4H2O 40mg、NaMoO4·2H2O 8mg、H3BO3 6mg、Ca(NO3)2·4H2O 800mg、FeSO4·7H2O 400mg、CuSO4·5H2O 80mg、去离子水1L。 维生素1溶液:对氨基苯甲酸40mg、生物素10mg、维生素B12 50mg、维生素B3 50mg、维生素B5 100mg、维生素B1 100mg、维生素B6 150mg、去离子水1L。 维生素2溶液:叶酸4mg、核黄素10mg、α-硫辛酸10mg、去离子水1L。 1.2 BaP厌氧降解菌群富集培养 本实验中供试的典型厌氧环境样品来自贵阳市某污水处理厂污泥-秸秆联合厌氧消化体系中的厌氧污泥(即为初始样品)。样品立即被带到实验室并用氮气处理,在使用前置于4℃保存,并在一周内开始实验。 在100mL棕色厌氧瓶中加入5mg/L BaP-乙腈溶液,待乙腈挥发后加入90mL基础培养基并通入氮气10min,随后经121℃高压蒸汽灭菌20min。待灭菌结束后在厌氧手套箱中往瓶内加入灭菌且无氧的无机盐离子培养基(0.1mL)、微量元素培养基(0.1mL)、维生素1和2溶液(0.02mL),补充20mM碳酸氢盐作为电子受体;各种培养基配制均参考前人研究。在培养基中加入污泥-秸秆联合厌氧污泥10mL,控制初始培养pH值为7.2~7.4。接种完成后将厌氧瓶放置于35℃,150r/min摇床进行培养,每隔7d以10%的接种量转接到新鲜液体培养基中,连续转接12次至30mg/L BaP-液体培养基中,定期转接保持菌液活性,并将此厌氧微生物菌群命名为YQ-BaP菌群。 1.3 宏基因测序 将微生物样品送至上海美吉生物医药科技有限公司,采用Fast DNA SPIN Kit for Soil试剂盒(MP bio,CA,USA)抽提DNA。完成抽提后,检验DNA的纯度和浓度,利用1%的琼脂糖胶对DNA的完整性进行检测。检测合格的片段进行剪切(约400bp)和连接,利用PCR扩增进行文库模板的富集,得到最终文库。桥式PCR后,采用IlluminaNovaSeq 6000平台进行高通量测序,随后使用fastp进行质量数据控制,将不同测序深度序列使用Megahit软件进行拼接组装,使用MetaGene对拼接结果中的contigs进行ORF预测,并将其翻译为氨基酸序列。使用CD-HIT软件将所有样品中预测出来的基因序列进行聚类(默认参数为:90%identity,90%coverage),构建非冗余基因集。使用BLASTP将非冗余基因集与NR数据库进行比对(BLAST比对参数设置期望值e-value为1e-5),以获得各个分类学水平上物种在各个样本中的丰度。 1.4 培养条件对菌群降解BaP的影响 本实验研究了pH值、温度、BaP初始浓度和单个金属离子对菌群去除BaP降解率的影响。当BaP浓度为20mg/L时,通过加入0.1M氢氧化钠或0.1M盐酸将培养基的初始pH值调整到5、6、7、8和9。培养温度分别设置为20、25、30、35和40℃,初始BaP浓度为20mg/L。当pH=7,培养温度为30℃时,设置了10、15、20、25和30mg/L的5种初始BaP浓度。分别添加10mg/L Fe2+、Cu2+、Pb2+、Zn2+和Cd2+5种不同金属离子,只含有BaP的样品作为对照组。每个实验组在第7天和第14天采集单个瓶的样品,测定残余BaP,并计算BaP的降解率,以阐明最佳条件。 1.5 菌群降解BaP的代谢产物 本实验采用了气相色谱-质谱联用技术(GC-MS)鉴定出YQ-BaP菌群厌氧降解过程中第1、7和14天BaP的代谢产物,推测了BaP厌氧降解的途径。在溶液中加入等体积的乙酸乙酯,振荡超声20min,循环萃取3次,离心5min(5000r/min),所得的萃取液旋蒸至干,加入20mL甲醇后旋蒸至1mL,使用GC-MS进行全波长扫描。色谱条件:HP-5MS色谱柱(30.0m×250μm,0.25μm),柱温温度为280℃,气化室温度280℃,传输线温度为280℃,载气He,载气流量1.0mL/min,分流比20∶1,进样量为1mL。电子离子源(EI)电压为70eV,温度为230℃,四极杆温度为150℃,扫描模式为Scan,扫描质量范围为33~500u。 1.6 BaP分析测试方法 BaP的提取和含量测定:在溶液中加入等体积的二氯甲烷,振荡30min后,离心5min(5000r/min),收集有机相。重复萃取2次,合并萃取液,加入适量Na2SO4除去萃取液中的水分,旋蒸氮吹至1mL后使用高效液相色谱仪进行测定。测定方法如下:色谱柱采用Athena C18(4.6×150mm,5μm,120A),流动相采用90%乙腈和10%纯净水,柱温为25℃,流速为1.0mL/min,检测波长为295nm。 为保证样品的检测质量,本研究设置了试剂空白和样品空白。试剂空白为不含BaP培养基,样品空白为不含YQ-BaP菌群培养基。回收率为61.66%~90.10%。标准曲线的线性方程为Y=13030X+5038,相关系数R2=0.9998。设计了3个平行实验和一个空白对照组。 2 结果与讨论 2.1 厌氧菌群的富集和群落结构 2.1.1 细菌群落多样性 初始样品和YQ-BaP菌群中细菌群落结构如图1所示,初始样品优势菌门为Actinobacteria(41.23%)、Chloroflexi(20.10%)、Proteobacteria(16.50%)。经过120d富集培养后,优势菌门变为Proteobacteria(94.49%)、Actinobacteria(2.57%)、Gemmatimonadetes(1.16%)。 图1 初始样品和YQ-BaP菌群在属水平上的群落结构 结果表明,Proteobacteria相对丰度增加了77.99%,Actinobacteria和Chloroflexi相对丰度分别减少了38.66%和20.10%。这可能是因为经过BaP富集培养后,微生物之间发生基因突变、复制,由此驯化得到降解PAHs的优势菌群。YQ-BaP菌群中Proteobacteria占绝对优势,在BaP的降解过程中发挥了重要作用。Proteobacteria在其他受PAHs污染的环境中也被发现是优势菌门。Sazykin等在俄罗斯热电厂附近受污染的土壤中分离出的6株PAHs可培养降解菌株均隶属于Actinobacteria。Martirani-Von Abercron等以硝酸盐为电子受体和PAHs为唯一碳源在受污染沉积物中所富集的菌群以Parcubacteria为优势菌门,而Proteobacteria仅占比15%。 为进一步明确菌群的类型,本研究在属分类水平下分析微生物多样性。与初始样品的微生物多样性相比,细菌群落组成发生了显著性变化。如图2所示,在初始样品中占比低于1%的菌属成为优势菌属,而原有的Candidatus_Microthrix、Candida⁃tus_Promineofilum和Anaerolinea逐渐减少或消失。YQ-BaP菌群主要包含Pseudomonas(41.30%)、Methyloversatilis(21.06%)、Ciceribacter(5.86%)和Alicycliphilus(5.53%)。Pseudomonas和Thauera的一些物种属于兼性菌,在厌氧条件下降解碳氢化合物。多数已成功分离的Nap好/厌氧降解菌株也属于Pseudomonas菌属。Methyloversatilis菌属曾被多次报道对PAHs产生降解作用并与PAHs的浓度呈现正相关。此外,Smalley等指出Methyloversatilis discipulorum的基因组显示存在与PAHs降解相关的多种基因,如编码环羟基化双加氧酶和儿茶酚2,3双加氧酶。其他占比不高的菌属,如Alicycliphilus、Thauera、Sphingomonas和Rhodococcus也常被报道可以降解碳氢化合物或多环芳烃。从海洋沉积物中富集培养出的BaP降解菌群优势菌属为Stenotrophomonas、Sulfurovum和Desulfosarcina,而YQ-BaP菌群的优势菌属是Pseudomonas、Methyloversatilis和Ciceribacter。 2.1.2 厌氧菌群对PAHs的降解率 该菌群除了降解BaP外,对菲和芘具有不同程度的降解,表现出一定的普适性。从图3可以看出,YQ-BaP菌群在7d后对30mg/L BaP和菲的降解率为38.69%和47.78%,而对芘的降解效果明显,培养7d后对30mg/L芘的降解率为38.57%,培养14d后降解率达到了79.59%。一般情况下,PAHs的分子量越大,微生物越难降解,菲和芘的分子量更小,水溶解度更高。本研究中,该菌群芘降解效果最好,可能是BaP厌氧降解过程会产生菲和芘这两种中间产物,厌氧降解菌群之间存在相似性,微生物生成和分泌这两种PAHs降解酶系。从海底2.5km处厌氧沉积物筛选出的白腐真菌Schizophyllium commune 20R-7-F01能对菲、芘和BaP都存在降解效果,但降解率不一,培养10d后降解率分别为25%、18%和13%。王慧等分离出的Thalssospira sp.strain TSL5-2,可降解菲、芘、荧蒽(初始质量浓度为20mg/L)和苯并蒽(8mg/L),但不能降解BaP。本研究富集的YQ-BaP菌群,可以降解3~5环的PAHs,尤其对芘的降解效果最好,存在PAHs污染修复应用潜力。 图3 YQ-BaP菌群对PAHs降解效果 2.2 培养条件对菌群降解BaP的影响 pH值在5~9,随着pH值的增大,BaP降解率呈现出先增大至稳定水平再减少的趋势。YQ-BaP菌群在中性条件下(pH值为6~7)均能较好生长,当初始pH值为7时,菌群的降解效率最高,对20mg/L BaP的去除率达到43.55%。当pH值为8和9时,BaP去除率明显下降。这可能是因为在碱性条件下部分微生物表面点位发生变化从而抑制其生长繁殖,过高的碱性会破坏微生物细胞渗透膜降低了微生物细胞的转运能力。多数芳香烃降解微生物都适合在近中性(pH值为6.5~7.5)的环境下生存。根据这些结果和实际环境考虑,选择pH=7作为后续的试验条件设置。 微生物对温度的适应情况与其组成及种类密切相关,不同菌群最适宜的生长温度也会有所不同。如图4(b)所示,培养14d后YQ-BaP菌群的BaP降解率随着温度升高而增加,当温度为35℃时,BaP降解率达到42.97%,降解效果最好。结果表明低温或高温环境都不利于YQ-BaP菌群对BaP的利用,这可能是因为过低或过高温度会导致菌群的生长繁殖受到抑制,使得降解代谢酶活性削弱或变性失活。该菌群在25~35℃温度范围内的降解效果不一,但可以表现出不同适应能力。 图4 YQ-BaP菌群在不同环境因素下的BaP降解率 pH=7和温度35℃的条件下,研究了BaP不同初始浓度对YQ-BaP菌群降解效果的影响,如图4(c)所示。培养14d后BaP不同初始浓度下降解率从大到小为20mg/L>30mg/L>25mg/L和30mg/L,当BaP浓度为10mg/L时,培养14d后BaP降解率为12.68%。随着BaP浓度的提高,YQ-BaP菌群对BaP的降解效果也随之增加,当BaP浓度为20mg/L时降解率最高,培养14d后可达到46.89%。BaP初始浓度高于20mg/L时,降解率趋于平稳,维持在39.75%左右。YQ-BaP菌群对较高浓度的BaP初始有耐受性。当BaP浓度过低时,菌群正常生长所需的碳源不足,从而影响代谢繁殖和降解效果。当BaP浓度大于20mg/L时对菌群中部分微生物细胞的胁迫作用更强,影响菌群正常的代谢活动。初始底物浓度过高或过低对降解实验效果均会产生影响。 PAHs与重金属都是环境中常见的持久性污染物,金属离子通常同时存在于受PAHs污染水体中。本实验中探究了不同金属离子对菌群降解能力的影响,结果如图4(d)所示。Cd2+、Zn2+和Pb2+对BaP厌氧降解起到抑制作用,培养14d后YQ-BaP菌群对BaP的降解率分别为21.09%、24.81%和19.43%,其中Pb2+的抑制作用最为明显。这可能是因为过高的金属离子浓度对菌群微生物造成毒害,使得降解酶系表达和活性受到影响。而Cu2+和Fe3+对BaP厌氧降解起到促进作用,培养14d后对BaP的降解率分别为64.84%和60.50%。说明YQ-BaP菌群对这两种重金属存在抗性。生物体中多数重要的氧化还原酶受到金属离子的调节,Csonga等认为Fe3+对羟化酶的活性至关重要。海洋沉积物中开发出的PAHs降解菌群DAK11对Mg2+、Mn2+、Pb2+、Fe3+和Cu2+均具有抗性作用,能有效降解Nap、Phe和Pyr等多种PAHs。 2.3 厌氧菌群的降解途径分析 根据各个质谱图的分子离子和主要碎片离子的大小,结合与NIST谱库中已有化合物的质谱图和现有文献报道的代谢产物质谱图比对,共确定到6种具有羧基、羟基或羰基的中间代谢产物,如:4,5-二氢苯并[a]芘、9,10-蒽醌、9,10-二氢蒽、苯甲酸、3-甲基水杨酸和苯酚(图5)。利用本研究所确定的代谢产物和之前从纯菌株培养所确定的BaP降解途径,推测出从厌氧污泥中富集的YQ-BaP菌群厌氧降解BaP的降解途径(图6)。 图5 YQ-BaP菌群代谢产物气质谱图 图6 YQ-BaP菌群对BaP的厌氧降解途径 (采用红色表示的化合物为额外添加的中间产物) 首先,BaP经过加氢作用形成4,5-二氢苯并[a]芘,4,5-二氢苯并[a]芘进一步环裂解转化菲,菲相对BaP而言更容易被生物降解。菲在羟化酶、氢化酶和甲基化酶的共同作用下可转为1、2、3、4-四氢菲再转化为含有两环的萘。而萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,在厌氧产甲烷环境中,发现苯酚可以氧化成苯甲酸,最后生成二氧化碳和甲烷。与之前报道的纯硝酸盐还原条件下BaP降解的代谢途径相比,本实验未发现芘、4,5-二氢芘、1-氨基芘等芘衍生物,这和菌群培养条件及初始环境有关。BaP经过第一个和第二个苯环的加氢形成11,12-二氢苯并[a]芘,随后可添加苯并[a]蒽和1,2,3,4-四氢化苯并[a]蒽等中间代谢产物完善逐步开环转化成蒽的降解途径。随后被氧化为9,10-蒽醌或是还原成9,10-二氢蒽,通过一系列渐进式开环最后产物被产甲烷菌降解利用生成甲烷和二氧化碳。 3 结论 从污泥-秸秆联合厌氧污泥体系中富集出的YQ-BaP菌群,该菌群最主要的菌门为Proteobacteria,约占94.49%,而优势菌属为Pseudomonas和Methyloversatilis。该菌群除能降解苯并[a]芘外,对菲和芘也有良好降解效果。YQ-BaP菌群对10~30mg/L浓度范围内的苯并[a]芘具有耐受性,在温度为35~40℃、pH=7、苯并[a]芘初始浓度为20mg/L时该菌群对苯并[a]芘的降解率可达到46.89%。该菌群可通过羟化、甲基化在厌氧环境下降解苯并[a]芘,首先加氢形成4,5-二氢苯并[a]芘,通过一系列反应环裂解转化菲,转化成二环的萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,最后被生成二氧化碳和甲烷。因此,该菌群在苯并[a]芘污染环境修复中具有很大的应用潜力。 本文作者:易倩文,肖芳,邹晓爽,李江,张云涛,代永恒,王斌,侯立安 作者简介:易倩文,贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),硕士研究生,研究方向为环境生物技术;李江(通信作者),贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),贵州喀斯特环境生态系统教育部野外科学观测研究站,教授,研究方向为有机固废资源化和新污染物治理;侯立安(共同通信作者),中国人民解放军96901部队23分队,中国工程院院士,正高级工程师,研究方向为饮用水安全保障、分散点源生活污水处理和人居环境空气净化等。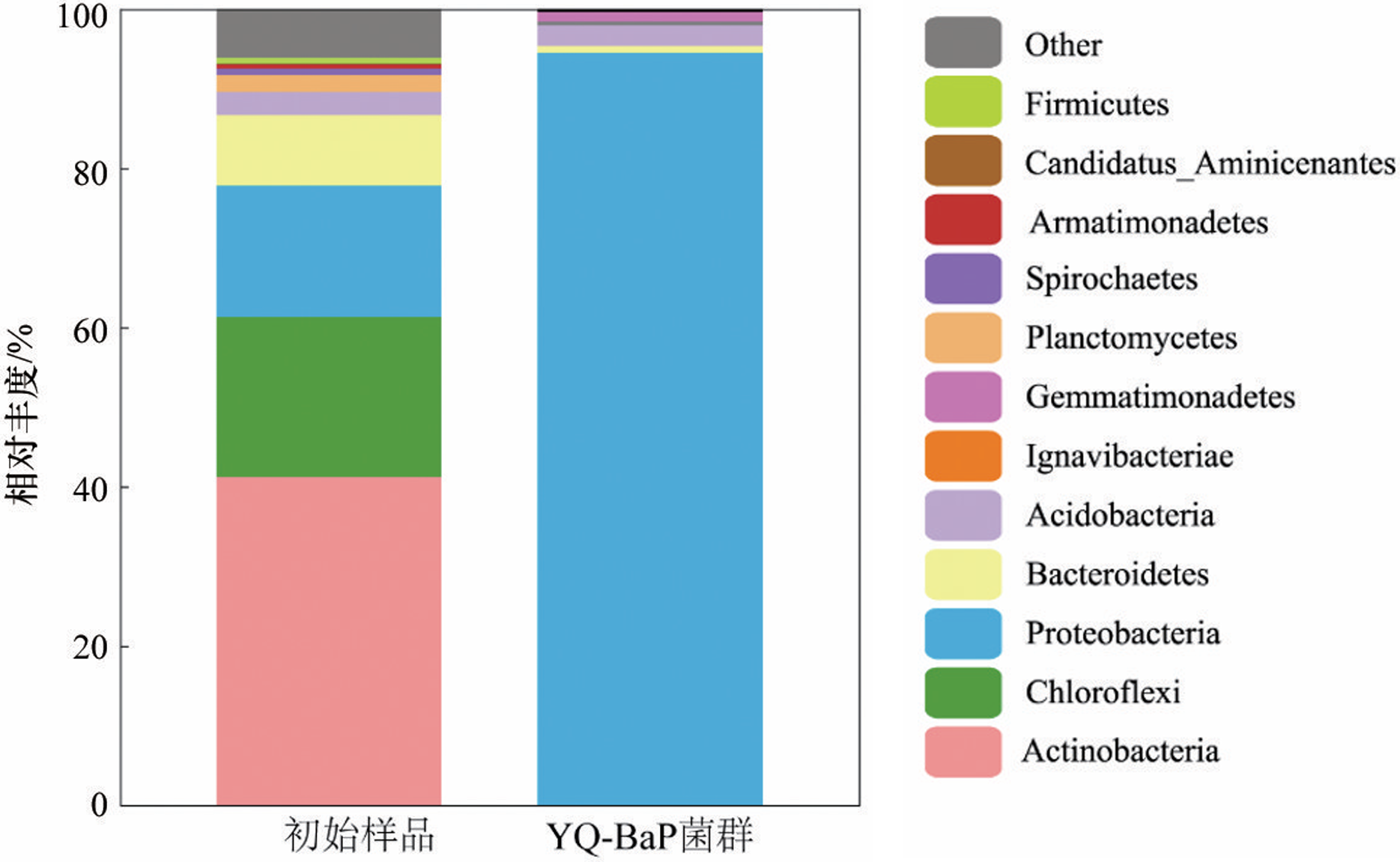
 图2 初始样品和YQ-BaP菌群在门水平上的群落结构
图2 初始样品和YQ-BaP菌群在门水平上的群落结构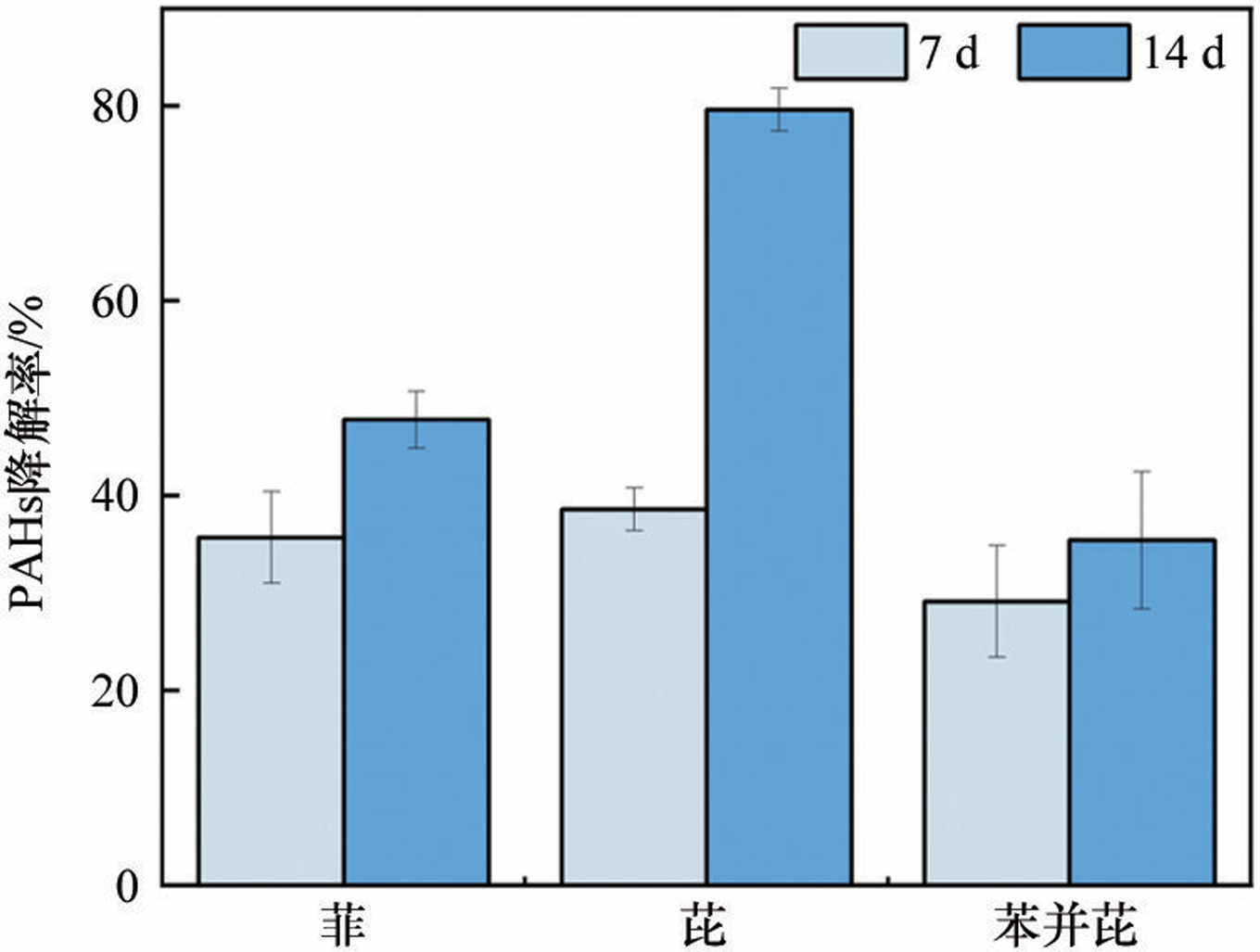

从污泥-秸秆联合厌氧污泥体系中富集出以BaP为唯一碳源的菌群——YQ-BaP菌群,通过单因素实验研究了不同环境因素对菌群降解能力的影响,采用GC-MS分析苯并[a]芘降解的中间代谢产物。结果表明:该菌群优势菌属为Pseudomonas和Methyloversatilis。该菌群在培养14d后对30mg/L BaP的降解率稳定在38.69%±6.24%,对菲和芘的降解效果更佳。YQ-BaP 菌群在pH=7和35~40℃时表现出较强的降解能力;当BaP初始浓度为20mg/L时,对BaP降解率达到46.89%。GC-MS分析表明,BaP在降解过程中产生菲、蒽和萘等羟化和甲基化代谢产物。研究显示,该菌群具有较强的BaP降解能力,可为多环芳烃污染环境的生物修复提供理论基础和技术支撑。
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是指分子中含有不少于两个苯环,以角状、线状或簇状等方式排列组合构成具有“三致”效应的持久性有机化合物。随着分子结构中苯环数量的增加,PAHs的疏水性、稳定性和毒性增强。作为高分子量PAHs的典型代表,苯并[a]芘具有强疏水性和低水溶性,易在沉积物、土壤和污泥等环境介质中吸附或富集。Shi等发现渭河干流及其支流沉积物中PAHs总致癌性最高可达到138.84mg/kg,其中苯并[a]芘对毒性当量的贡献占44.6%。苯并[a]芘在焦化厂土壤中浓度为110±18.0mg/kg,污染深度高达10m以上,在北京、广州和上海等城市土壤中也发现不同程度的PAHs污染。城市污水处理厂污泥的多环芳烃毒性风险研究中发现苯并[a]芘和二苯并蒽毒性当量最高。由于苯并[a]芘对人类健康和生态系统构成危害,开展苯并[a]芘污染的治理技术研究具有重要意义。 PAHs污染环境的生物修复具有效果好、成本低和无二次污染等特点,是目前最具潜力的PAHs污染治理技术之一。PAHs在好氧环境中易降解,并从中分离富集出诸多好氧降解菌,包括芽孢杆菌、莫拉氏菌、克雷伯氏菌和不动杆菌等。PAHs好氧降解的代谢途径研究较成熟,PAHs通过双加氧酶加氧和脱氢反应生成对应的芳香族二羟基化合物,随后氧化裂解成可生物利用化合物,最后彻底降解。但在厌氧条件下,因微生物代谢缓慢以及缺少氧气作为电子受体使PAHs厌氧降解途径鲜有报道,针对高分子量多环芳烃的厌氧降解过程更是知之甚少。Liang等分离出的假单胞菌JP1在硝酸盐还原条件下可降解菲、荧蒽和苯并[a]芘,培养40d后对10mg/L苯并[a]芘的降解率为30%;而白腐真菌Schizophyllium commune20R-7-F01在培养10d后对50mg/L苯并[a]芘的降解率仅为13.1%。Qin等利用Microbacterium sp.菌株证实了苯并[a]芘的降解过程遵循渐式开环模式。此外,有报道指出苯并[a]芘厌氧生物降解的初始化过程为甲基化或者羧基化,目前关于苯并[a]芘厌氧生物降解途径并未明晰,仅其少数中间代谢产物被证实,例如:二氢苯并[a]芘、芘、菲、萘和蒽等。现有研究主要集中在筛选分离出单菌株降解BaP的代谢产物,有关功能混合菌群降解BaP的化学途径却鲜有报道。此外,环境中多环芳烃降解微生物无法全部进行分离纯化培养且单一菌株对环境要求苛刻,因此可利用宏基因组学来确定富集所得菌群的多样性和功能。目前,关于BaP厌氧降解的研究主要集中于河流沉积物、地下水、深层土壤和海洋沉积物,而对于城市污泥厌氧消化这类典型厌氧环境中多环芳烃生物降解研究较为缺乏,且体系中降解机理研究不够深入。 本研究从污泥-秸秆联合厌氧消化体系中富集出BaP厌氧降解菌群,对降解条件及其性能进行优化研究;采用GC-MS分析鉴别出BaP厌氧降解代谢产物。 1 材料与方法 1.1 培养基 基础培养基:NH4Cl 1.2g、K2HPO4 0.27g、KH2PO4 0.35g、去离子水1 L。 无机盐离子培养基:CaCl2·2H2O 0.1g、MgCl2 0.1g、FeCl2·4H2O 0.02g、Na2S 0.005g、刃天青0.001g、去离子水1L。 微量元素培养基:ZnSO4·7H2O 40mg、MnSO4·4H2O 40mg、NaMoO4·2H2O 8mg、H3BO3 6mg、Ca(NO3)2·4H2O 800mg、FeSO4·7H2O 400mg、CuSO4·5H2O 80mg、去离子水1L。 维生素1溶液:对氨基苯甲酸40mg、生物素10mg、维生素B12 50mg、维生素B3 50mg、维生素B5 100mg、维生素B1 100mg、维生素B6 150mg、去离子水1L。 维生素2溶液:叶酸4mg、核黄素10mg、α-硫辛酸10mg、去离子水1L。 1.2 BaP厌氧降解菌群富集培养 本实验中供试的典型厌氧环境样品来自贵阳市某污水处理厂污泥-秸秆联合厌氧消化体系中的厌氧污泥(即为初始样品)。样品立即被带到实验室并用氮气处理,在使用前置于4℃保存,并在一周内开始实验。 在100mL棕色厌氧瓶中加入5mg/L BaP-乙腈溶液,待乙腈挥发后加入90mL基础培养基并通入氮气10min,随后经121℃高压蒸汽灭菌20min。待灭菌结束后在厌氧手套箱中往瓶内加入灭菌且无氧的无机盐离子培养基(0.1mL)、微量元素培养基(0.1mL)、维生素1和2溶液(0.02mL),补充20mM碳酸氢盐作为电子受体;各种培养基配制均参考前人研究。在培养基中加入污泥-秸秆联合厌氧污泥10mL,控制初始培养pH值为7.2~7.4。接种完成后将厌氧瓶放置于35℃,150r/min摇床进行培养,每隔7d以10%的接种量转接到新鲜液体培养基中,连续转接12次至30mg/L BaP-液体培养基中,定期转接保持菌液活性,并将此厌氧微生物菌群命名为YQ-BaP菌群。 1.3 宏基因测序 将微生物样品送至上海美吉生物医药科技有限公司,采用Fast DNA SPIN Kit for Soil试剂盒(MP bio,CA,USA)抽提DNA。完成抽提后,检验DNA的纯度和浓度,利用1%的琼脂糖胶对DNA的完整性进行检测。检测合格的片段进行剪切(约400bp)和连接,利用PCR扩增进行文库模板的富集,得到最终文库。桥式PCR后,采用IlluminaNovaSeq 6000平台进行高通量测序,随后使用fastp进行质量数据控制,将不同测序深度序列使用Megahit软件进行拼接组装,使用MetaGene对拼接结果中的contigs进行ORF预测,并将其翻译为氨基酸序列。使用CD-HIT软件将所有样品中预测出来的基因序列进行聚类(默认参数为:90%identity,90%coverage),构建非冗余基因集。使用BLASTP将非冗余基因集与NR数据库进行比对(BLAST比对参数设置期望值e-value为1e-5),以获得各个分类学水平上物种在各个样本中的丰度。 1.4 培养条件对菌群降解BaP的影响 本实验研究了pH值、温度、BaP初始浓度和单个金属离子对菌群去除BaP降解率的影响。当BaP浓度为20mg/L时,通过加入0.1M氢氧化钠或0.1M盐酸将培养基的初始pH值调整到5、6、7、8和9。培养温度分别设置为20、25、30、35和40℃,初始BaP浓度为20mg/L。当pH=7,培养温度为30℃时,设置了10、15、20、25和30mg/L的5种初始BaP浓度。分别添加10mg/L Fe2+、Cu2+、Pb2+、Zn2+和Cd2+5种不同金属离子,只含有BaP的样品作为对照组。每个实验组在第7天和第14天采集单个瓶的样品,测定残余BaP,并计算BaP的降解率,以阐明最佳条件。 1.5 菌群降解BaP的代谢产物 本实验采用了气相色谱-质谱联用技术(GC-MS)鉴定出YQ-BaP菌群厌氧降解过程中第1、7和14天BaP的代谢产物,推测了BaP厌氧降解的途径。在溶液中加入等体积的乙酸乙酯,振荡超声20min,循环萃取3次,离心5min(5000r/min),所得的萃取液旋蒸至干,加入20mL甲醇后旋蒸至1mL,使用GC-MS进行全波长扫描。色谱条件:HP-5MS色谱柱(30.0m×250μm,0.25μm),柱温温度为280℃,气化室温度280℃,传输线温度为280℃,载气He,载气流量1.0mL/min,分流比20∶1,进样量为1mL。电子离子源(EI)电压为70eV,温度为230℃,四极杆温度为150℃,扫描模式为Scan,扫描质量范围为33~500u。 1.6 BaP分析测试方法 BaP的提取和含量测定:在溶液中加入等体积的二氯甲烷,振荡30min后,离心5min(5000r/min),收集有机相。重复萃取2次,合并萃取液,加入适量Na2SO4除去萃取液中的水分,旋蒸氮吹至1mL后使用高效液相色谱仪进行测定。测定方法如下:色谱柱采用Athena C18(4.6×150mm,5μm,120A),流动相采用90%乙腈和10%纯净水,柱温为25℃,流速为1.0mL/min,检测波长为295nm。 为保证样品的检测质量,本研究设置了试剂空白和样品空白。试剂空白为不含BaP培养基,样品空白为不含YQ-BaP菌群培养基。回收率为61.66%~90.10%。标准曲线的线性方程为Y=13030X+5038,相关系数R2=0.9998。设计了3个平行实验和一个空白对照组。 2 结果与讨论 2.1 厌氧菌群的富集和群落结构 2.1.1 细菌群落多样性 初始样品和YQ-BaP菌群中细菌群落结构如图1所示,初始样品优势菌门为Actinobacteria(41.23%)、Chloroflexi(20.10%)、Proteobacteria(16.50%)。经过120d富集培养后,优势菌门变为Proteobacteria(94.49%)、Actinobacteria(2.57%)、Gemmatimonadetes(1.16%)。 图1 初始样品和YQ-BaP菌群在属水平上的群落结构 结果表明,Proteobacteria相对丰度增加了77.99%,Actinobacteria和Chloroflexi相对丰度分别减少了38.66%和20.10%。这可能是因为经过BaP富集培养后,微生物之间发生基因突变、复制,由此驯化得到降解PAHs的优势菌群。YQ-BaP菌群中Proteobacteria占绝对优势,在BaP的降解过程中发挥了重要作用。Proteobacteria在其他受PAHs污染的环境中也被发现是优势菌门。Sazykin等在俄罗斯热电厂附近受污染的土壤中分离出的6株PAHs可培养降解菌株均隶属于Actinobacteria。Martirani-Von Abercron等以硝酸盐为电子受体和PAHs为唯一碳源在受污染沉积物中所富集的菌群以Parcubacteria为优势菌门,而Proteobacteria仅占比15%。 为进一步明确菌群的类型,本研究在属分类水平下分析微生物多样性。与初始样品的微生物多样性相比,细菌群落组成发生了显著性变化。如图2所示,在初始样品中占比低于1%的菌属成为优势菌属,而原有的Candidatus_Microthrix、Candida⁃tus_Promineofilum和Anaerolinea逐渐减少或消失。YQ-BaP菌群主要包含Pseudomonas(41.30%)、Methyloversatilis(21.06%)、Ciceribacter(5.86%)和Alicycliphilus(5.53%)。Pseudomonas和Thauera的一些物种属于兼性菌,在厌氧条件下降解碳氢化合物。多数已成功分离的Nap好/厌氧降解菌株也属于Pseudomonas菌属。Methyloversatilis菌属曾被多次报道对PAHs产生降解作用并与PAHs的浓度呈现正相关。此外,Smalley等指出Methyloversatilis discipulorum的基因组显示存在与PAHs降解相关的多种基因,如编码环羟基化双加氧酶和儿茶酚2,3双加氧酶。其他占比不高的菌属,如Alicycliphilus、Thauera、Sphingomonas和Rhodococcus也常被报道可以降解碳氢化合物或多环芳烃。从海洋沉积物中富集培养出的BaP降解菌群优势菌属为Stenotrophomonas、Sulfurovum和Desulfosarcina,而YQ-BaP菌群的优势菌属是Pseudomonas、Methyloversatilis和Ciceribacter。 2.1.2 厌氧菌群对PAHs的降解率 该菌群除了降解BaP外,对菲和芘具有不同程度的降解,表现出一定的普适性。从图3可以看出,YQ-BaP菌群在7d后对30mg/L BaP和菲的降解率为38.69%和47.78%,而对芘的降解效果明显,培养7d后对30mg/L芘的降解率为38.57%,培养14d后降解率达到了79.59%。一般情况下,PAHs的分子量越大,微生物越难降解,菲和芘的分子量更小,水溶解度更高。本研究中,该菌群芘降解效果最好,可能是BaP厌氧降解过程会产生菲和芘这两种中间产物,厌氧降解菌群之间存在相似性,微生物生成和分泌这两种PAHs降解酶系。从海底2.5km处厌氧沉积物筛选出的白腐真菌Schizophyllium commune 20R-7-F01能对菲、芘和BaP都存在降解效果,但降解率不一,培养10d后降解率分别为25%、18%和13%。王慧等分离出的Thalssospira sp.strain TSL5-2,可降解菲、芘、荧蒽(初始质量浓度为20mg/L)和苯并蒽(8mg/L),但不能降解BaP。本研究富集的YQ-BaP菌群,可以降解3~5环的PAHs,尤其对芘的降解效果最好,存在PAHs污染修复应用潜力。 图3 YQ-BaP菌群对PAHs降解效果 2.2 培养条件对菌群降解BaP的影响 pH值在5~9,随着pH值的增大,BaP降解率呈现出先增大至稳定水平再减少的趋势。YQ-BaP菌群在中性条件下(pH值为6~7)均能较好生长,当初始pH值为7时,菌群的降解效率最高,对20mg/L BaP的去除率达到43.55%。当pH值为8和9时,BaP去除率明显下降。这可能是因为在碱性条件下部分微生物表面点位发生变化从而抑制其生长繁殖,过高的碱性会破坏微生物细胞渗透膜降低了微生物细胞的转运能力。多数芳香烃降解微生物都适合在近中性(pH值为6.5~7.5)的环境下生存。根据这些结果和实际环境考虑,选择pH=7作为后续的试验条件设置。 微生物对温度的适应情况与其组成及种类密切相关,不同菌群最适宜的生长温度也会有所不同。如图4(b)所示,培养14d后YQ-BaP菌群的BaP降解率随着温度升高而增加,当温度为35℃时,BaP降解率达到42.97%,降解效果最好。结果表明低温或高温环境都不利于YQ-BaP菌群对BaP的利用,这可能是因为过低或过高温度会导致菌群的生长繁殖受到抑制,使得降解代谢酶活性削弱或变性失活。该菌群在25~35℃温度范围内的降解效果不一,但可以表现出不同适应能力。 图4 YQ-BaP菌群在不同环境因素下的BaP降解率 pH=7和温度35℃的条件下,研究了BaP不同初始浓度对YQ-BaP菌群降解效果的影响,如图4(c)所示。培养14d后BaP不同初始浓度下降解率从大到小为20mg/L>30mg/L>25mg/L和30mg/L,当BaP浓度为10mg/L时,培养14d后BaP降解率为12.68%。随着BaP浓度的提高,YQ-BaP菌群对BaP的降解效果也随之增加,当BaP浓度为20mg/L时降解率最高,培养14d后可达到46.89%。BaP初始浓度高于20mg/L时,降解率趋于平稳,维持在39.75%左右。YQ-BaP菌群对较高浓度的BaP初始有耐受性。当BaP浓度过低时,菌群正常生长所需的碳源不足,从而影响代谢繁殖和降解效果。当BaP浓度大于20mg/L时对菌群中部分微生物细胞的胁迫作用更强,影响菌群正常的代谢活动。初始底物浓度过高或过低对降解实验效果均会产生影响。 PAHs与重金属都是环境中常见的持久性污染物,金属离子通常同时存在于受PAHs污染水体中。本实验中探究了不同金属离子对菌群降解能力的影响,结果如图4(d)所示。Cd2+、Zn2+和Pb2+对BaP厌氧降解起到抑制作用,培养14d后YQ-BaP菌群对BaP的降解率分别为21.09%、24.81%和19.43%,其中Pb2+的抑制作用最为明显。这可能是因为过高的金属离子浓度对菌群微生物造成毒害,使得降解酶系表达和活性受到影响。而Cu2+和Fe3+对BaP厌氧降解起到促进作用,培养14d后对BaP的降解率分别为64.84%和60.50%。说明YQ-BaP菌群对这两种重金属存在抗性。生物体中多数重要的氧化还原酶受到金属离子的调节,Csonga等认为Fe3+对羟化酶的活性至关重要。海洋沉积物中开发出的PAHs降解菌群DAK11对Mg2+、Mn2+、Pb2+、Fe3+和Cu2+均具有抗性作用,能有效降解Nap、Phe和Pyr等多种PAHs。 2.3 厌氧菌群的降解途径分析 根据各个质谱图的分子离子和主要碎片离子的大小,结合与NIST谱库中已有化合物的质谱图和现有文献报道的代谢产物质谱图比对,共确定到6种具有羧基、羟基或羰基的中间代谢产物,如:4,5-二氢苯并[a]芘、9,10-蒽醌、9,10-二氢蒽、苯甲酸、3-甲基水杨酸和苯酚(图5)。利用本研究所确定的代谢产物和之前从纯菌株培养所确定的BaP降解途径,推测出从厌氧污泥中富集的YQ-BaP菌群厌氧降解BaP的降解途径(图6)。 图5 YQ-BaP菌群代谢产物气质谱图 图6 YQ-BaP菌群对BaP的厌氧降解途径 (采用红色表示的化合物为额外添加的中间产物) 首先,BaP经过加氢作用形成4,5-二氢苯并[a]芘,4,5-二氢苯并[a]芘进一步环裂解转化菲,菲相对BaP而言更容易被生物降解。菲在羟化酶、氢化酶和甲基化酶的共同作用下可转为1、2、3、4-四氢菲再转化为含有两环的萘。而萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,在厌氧产甲烷环境中,发现苯酚可以氧化成苯甲酸,最后生成二氧化碳和甲烷。与之前报道的纯硝酸盐还原条件下BaP降解的代谢途径相比,本实验未发现芘、4,5-二氢芘、1-氨基芘等芘衍生物,这和菌群培养条件及初始环境有关。BaP经过第一个和第二个苯环的加氢形成11,12-二氢苯并[a]芘,随后可添加苯并[a]蒽和1,2,3,4-四氢化苯并[a]蒽等中间代谢产物完善逐步开环转化成蒽的降解途径。随后被氧化为9,10-蒽醌或是还原成9,10-二氢蒽,通过一系列渐进式开环最后产物被产甲烷菌降解利用生成甲烷和二氧化碳。 3 结论 从污泥-秸秆联合厌氧污泥体系中富集出的YQ-BaP菌群,该菌群最主要的菌门为Proteobacteria,约占94.49%,而优势菌属为Pseudomonas和Methyloversatilis。该菌群除能降解苯并[a]芘外,对菲和芘也有良好降解效果。YQ-BaP菌群对10~30mg/L浓度范围内的苯并[a]芘具有耐受性,在温度为35~40℃、pH=7、苯并[a]芘初始浓度为20mg/L时该菌群对苯并[a]芘的降解率可达到46.89%。该菌群可通过羟化、甲基化在厌氧环境下降解苯并[a]芘,首先加氢形成4,5-二氢苯并[a]芘,通过一系列反应环裂解转化菲,转化成二环的萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,最后被生成二氧化碳和甲烷。因此,该菌群在苯并[a]芘污染环境修复中具有很大的应用潜力。 本文作者:易倩文,肖芳,邹晓爽,李江,张云涛,代永恒,王斌,侯立安 作者简介:易倩文,贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),硕士研究生,研究方向为环境生物技术;李江(通信作者),贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),贵州喀斯特环境生态系统教育部野外科学观测研究站,教授,研究方向为有机固废资源化和新污染物治理;侯立安(共同通信作者),中国人民解放军96901部队23分队,中国工程院院士,正高级工程师,研究方向为饮用水安全保障、分散点源生活污水处理和人居环境空气净化等。
 图2 初始样品和YQ-BaP菌群在门水平上的群落结构
图2 初始样品和YQ-BaP菌群在门水平上的群落结构




从污泥-秸秆联合厌氧污泥体系中富集出以BaP为唯一碳源的菌群——YQ-BaP菌群,通过单因素实验研究了不同环境因素对菌群降解能力的影响,采用GC-MS分析苯并[a]芘降解的中间代谢产物。结果表明:该菌群优势菌属为Pseudomonas和Methyloversatilis。该菌群在培养14d后对30mg/L BaP的降解率稳定在38.69%±6.24%,对菲和芘的降解效果更佳。YQ-BaP 菌群在pH=7和35~40℃时表现出较强的降解能力;当BaP初始浓度为20mg/L时,对BaP降解率达到46.89%。GC-MS分析表明,BaP在降解过程中产生菲、蒽和萘等羟化和甲基化代谢产物。研究显示,该菌群具有较强的BaP降解能力,可为多环芳烃污染环境的生物修复提供理论基础和技术支撑。
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是指分子中含有不少于两个苯环,以角状、线状或簇状等方式排列组合构成具有“三致”效应的持久性有机化合物。随着分子结构中苯环数量的增加,PAHs的疏水性、稳定性和毒性增强。作为高分子量PAHs的典型代表,苯并[a]芘具有强疏水性和低水溶性,易在沉积物、土壤和污泥等环境介质中吸附或富集。Shi等发现渭河干流及其支流沉积物中PAHs总致癌性最高可达到138.84mg/kg,其中苯并[a]芘对毒性当量的贡献占44.6%。苯并[a]芘在焦化厂土壤中浓度为110±18.0mg/kg,污染深度高达10m以上,在北京、广州和上海等城市土壤中也发现不同程度的PAHs污染。城市污水处理厂污泥的多环芳烃毒性风险研究中发现苯并[a]芘和二苯并蒽毒性当量最高。由于苯并[a]芘对人类健康和生态系统构成危害,开展苯并[a]芘污染的治理技术研究具有重要意义。 PAHs污染环境的生物修复具有效果好、成本低和无二次污染等特点,是目前最具潜力的PAHs污染治理技术之一。PAHs在好氧环境中易降解,并从中分离富集出诸多好氧降解菌,包括芽孢杆菌、莫拉氏菌、克雷伯氏菌和不动杆菌等。PAHs好氧降解的代谢途径研究较成熟,PAHs通过双加氧酶加氧和脱氢反应生成对应的芳香族二羟基化合物,随后氧化裂解成可生物利用化合物,最后彻底降解。但在厌氧条件下,因微生物代谢缓慢以及缺少氧气作为电子受体使PAHs厌氧降解途径鲜有报道,针对高分子量多环芳烃的厌氧降解过程更是知之甚少。Liang等分离出的假单胞菌JP1在硝酸盐还原条件下可降解菲、荧蒽和苯并[a]芘,培养40d后对10mg/L苯并[a]芘的降解率为30%;而白腐真菌Schizophyllium commune20R-7-F01在培养10d后对50mg/L苯并[a]芘的降解率仅为13.1%。Qin等利用Microbacterium sp.菌株证实了苯并[a]芘的降解过程遵循渐式开环模式。此外,有报道指出苯并[a]芘厌氧生物降解的初始化过程为甲基化或者羧基化,目前关于苯并[a]芘厌氧生物降解途径并未明晰,仅其少数中间代谢产物被证实,例如:二氢苯并[a]芘、芘、菲、萘和蒽等。现有研究主要集中在筛选分离出单菌株降解BaP的代谢产物,有关功能混合菌群降解BaP的化学途径却鲜有报道。此外,环境中多环芳烃降解微生物无法全部进行分离纯化培养且单一菌株对环境要求苛刻,因此可利用宏基因组学来确定富集所得菌群的多样性和功能。目前,关于BaP厌氧降解的研究主要集中于河流沉积物、地下水、深层土壤和海洋沉积物,而对于城市污泥厌氧消化这类典型厌氧环境中多环芳烃生物降解研究较为缺乏,且体系中降解机理研究不够深入。 本研究从污泥-秸秆联合厌氧消化体系中富集出BaP厌氧降解菌群,对降解条件及其性能进行优化研究;采用GC-MS分析鉴别出BaP厌氧降解代谢产物。 1 材料与方法 1.1 培养基 基础培养基:NH4Cl 1.2g、K2HPO4 0.27g、KH2PO4 0.35g、去离子水1 L。 无机盐离子培养基:CaCl2·2H2O 0.1g、MgCl2 0.1g、FeCl2·4H2O 0.02g、Na2S 0.005g、刃天青0.001g、去离子水1L。 微量元素培养基:ZnSO4·7H2O 40mg、MnSO4·4H2O 40mg、NaMoO4·2H2O 8mg、H3BO3 6mg、Ca(NO3)2·4H2O 800mg、FeSO4·7H2O 400mg、CuSO4·5H2O 80mg、去离子水1L。 维生素1溶液:对氨基苯甲酸40mg、生物素10mg、维生素B12 50mg、维生素B3 50mg、维生素B5 100mg、维生素B1 100mg、维生素B6 150mg、去离子水1L。 维生素2溶液:叶酸4mg、核黄素10mg、α-硫辛酸10mg、去离子水1L。 1.2 BaP厌氧降解菌群富集培养 本实验中供试的典型厌氧环境样品来自贵阳市某污水处理厂污泥-秸秆联合厌氧消化体系中的厌氧污泥(即为初始样品)。样品立即被带到实验室并用氮气处理,在使用前置于4℃保存,并在一周内开始实验。 在100mL棕色厌氧瓶中加入5mg/L BaP-乙腈溶液,待乙腈挥发后加入90mL基础培养基并通入氮气10min,随后经121℃高压蒸汽灭菌20min。待灭菌结束后在厌氧手套箱中往瓶内加入灭菌且无氧的无机盐离子培养基(0.1mL)、微量元素培养基(0.1mL)、维生素1和2溶液(0.02mL),补充20mM碳酸氢盐作为电子受体;各种培养基配制均参考前人研究。在培养基中加入污泥-秸秆联合厌氧污泥10mL,控制初始培养pH值为7.2~7.4。接种完成后将厌氧瓶放置于35℃,150r/min摇床进行培养,每隔7d以10%的接种量转接到新鲜液体培养基中,连续转接12次至30mg/L BaP-液体培养基中,定期转接保持菌液活性,并将此厌氧微生物菌群命名为YQ-BaP菌群。 1.3 宏基因测序 将微生物样品送至上海美吉生物医药科技有限公司,采用Fast DNA SPIN Kit for Soil试剂盒(MP bio,CA,USA)抽提DNA。完成抽提后,检验DNA的纯度和浓度,利用1%的琼脂糖胶对DNA的完整性进行检测。检测合格的片段进行剪切(约400bp)和连接,利用PCR扩增进行文库模板的富集,得到最终文库。桥式PCR后,采用IlluminaNovaSeq 6000平台进行高通量测序,随后使用fastp进行质量数据控制,将不同测序深度序列使用Megahit软件进行拼接组装,使用MetaGene对拼接结果中的contigs进行ORF预测,并将其翻译为氨基酸序列。使用CD-HIT软件将所有样品中预测出来的基因序列进行聚类(默认参数为:90%identity,90%coverage),构建非冗余基因集。使用BLASTP将非冗余基因集与NR数据库进行比对(BLAST比对参数设置期望值e-value为1e-5),以获得各个分类学水平上物种在各个样本中的丰度。 1.4 培养条件对菌群降解BaP的影响 本实验研究了pH值、温度、BaP初始浓度和单个金属离子对菌群去除BaP降解率的影响。当BaP浓度为20mg/L时,通过加入0.1M氢氧化钠或0.1M盐酸将培养基的初始pH值调整到5、6、7、8和9。培养温度分别设置为20、25、30、35和40℃,初始BaP浓度为20mg/L。当pH=7,培养温度为30℃时,设置了10、15、20、25和30mg/L的5种初始BaP浓度。分别添加10mg/L Fe2+、Cu2+、Pb2+、Zn2+和Cd2+5种不同金属离子,只含有BaP的样品作为对照组。每个实验组在第7天和第14天采集单个瓶的样品,测定残余BaP,并计算BaP的降解率,以阐明最佳条件。 1.5 菌群降解BaP的代谢产物 本实验采用了气相色谱-质谱联用技术(GC-MS)鉴定出YQ-BaP菌群厌氧降解过程中第1、7和14天BaP的代谢产物,推测了BaP厌氧降解的途径。在溶液中加入等体积的乙酸乙酯,振荡超声20min,循环萃取3次,离心5min(5000r/min),所得的萃取液旋蒸至干,加入20mL甲醇后旋蒸至1mL,使用GC-MS进行全波长扫描。色谱条件:HP-5MS色谱柱(30.0m×250μm,0.25μm),柱温温度为280℃,气化室温度280℃,传输线温度为280℃,载气He,载气流量1.0mL/min,分流比20∶1,进样量为1mL。电子离子源(EI)电压为70eV,温度为230℃,四极杆温度为150℃,扫描模式为Scan,扫描质量范围为33~500u。 1.6 BaP分析测试方法 BaP的提取和含量测定:在溶液中加入等体积的二氯甲烷,振荡30min后,离心5min(5000r/min),收集有机相。重复萃取2次,合并萃取液,加入适量Na2SO4除去萃取液中的水分,旋蒸氮吹至1mL后使用高效液相色谱仪进行测定。测定方法如下:色谱柱采用Athena C18(4.6×150mm,5μm,120A),流动相采用90%乙腈和10%纯净水,柱温为25℃,流速为1.0mL/min,检测波长为295nm。 为保证样品的检测质量,本研究设置了试剂空白和样品空白。试剂空白为不含BaP培养基,样品空白为不含YQ-BaP菌群培养基。回收率为61.66%~90.10%。标准曲线的线性方程为Y=13030X+5038,相关系数R2=0.9998。设计了3个平行实验和一个空白对照组。 2 结果与讨论 2.1 厌氧菌群的富集和群落结构 2.1.1 细菌群落多样性 初始样品和YQ-BaP菌群中细菌群落结构如图1所示,初始样品优势菌门为Actinobacteria(41.23%)、Chloroflexi(20.10%)、Proteobacteria(16.50%)。经过120d富集培养后,优势菌门变为Proteobacteria(94.49%)、Actinobacteria(2.57%)、Gemmatimonadetes(1.16%)。 图1 初始样品和YQ-BaP菌群在属水平上的群落结构 结果表明,Proteobacteria相对丰度增加了77.99%,Actinobacteria和Chloroflexi相对丰度分别减少了38.66%和20.10%。这可能是因为经过BaP富集培养后,微生物之间发生基因突变、复制,由此驯化得到降解PAHs的优势菌群。YQ-BaP菌群中Proteobacteria占绝对优势,在BaP的降解过程中发挥了重要作用。Proteobacteria在其他受PAHs污染的环境中也被发现是优势菌门。Sazykin等在俄罗斯热电厂附近受污染的土壤中分离出的6株PAHs可培养降解菌株均隶属于Actinobacteria。Martirani-Von Abercron等以硝酸盐为电子受体和PAHs为唯一碳源在受污染沉积物中所富集的菌群以Parcubacteria为优势菌门,而Proteobacteria仅占比15%。 为进一步明确菌群的类型,本研究在属分类水平下分析微生物多样性。与初始样品的微生物多样性相比,细菌群落组成发生了显著性变化。如图2所示,在初始样品中占比低于1%的菌属成为优势菌属,而原有的Candidatus_Microthrix、Candida⁃tus_Promineofilum和Anaerolinea逐渐减少或消失。YQ-BaP菌群主要包含Pseudomonas(41.30%)、Methyloversatilis(21.06%)、Ciceribacter(5.86%)和Alicycliphilus(5.53%)。Pseudomonas和Thauera的一些物种属于兼性菌,在厌氧条件下降解碳氢化合物。多数已成功分离的Nap好/厌氧降解菌株也属于Pseudomonas菌属。Methyloversatilis菌属曾被多次报道对PAHs产生降解作用并与PAHs的浓度呈现正相关。此外,Smalley等指出Methyloversatilis discipulorum的基因组显示存在与PAHs降解相关的多种基因,如编码环羟基化双加氧酶和儿茶酚2,3双加氧酶。其他占比不高的菌属,如Alicycliphilus、Thauera、Sphingomonas和Rhodococcus也常被报道可以降解碳氢化合物或多环芳烃。从海洋沉积物中富集培养出的BaP降解菌群优势菌属为Stenotrophomonas、Sulfurovum和Desulfosarcina,而YQ-BaP菌群的优势菌属是Pseudomonas、Methyloversatilis和Ciceribacter。 2.1.2 厌氧菌群对PAHs的降解率 该菌群除了降解BaP外,对菲和芘具有不同程度的降解,表现出一定的普适性。从图3可以看出,YQ-BaP菌群在7d后对30mg/L BaP和菲的降解率为38.69%和47.78%,而对芘的降解效果明显,培养7d后对30mg/L芘的降解率为38.57%,培养14d后降解率达到了79.59%。一般情况下,PAHs的分子量越大,微生物越难降解,菲和芘的分子量更小,水溶解度更高。本研究中,该菌群芘降解效果最好,可能是BaP厌氧降解过程会产生菲和芘这两种中间产物,厌氧降解菌群之间存在相似性,微生物生成和分泌这两种PAHs降解酶系。从海底2.5km处厌氧沉积物筛选出的白腐真菌Schizophyllium commune 20R-7-F01能对菲、芘和BaP都存在降解效果,但降解率不一,培养10d后降解率分别为25%、18%和13%。王慧等分离出的Thalssospira sp.strain TSL5-2,可降解菲、芘、荧蒽(初始质量浓度为20mg/L)和苯并蒽(8mg/L),但不能降解BaP。本研究富集的YQ-BaP菌群,可以降解3~5环的PAHs,尤其对芘的降解效果最好,存在PAHs污染修复应用潜力。 图3 YQ-BaP菌群对PAHs降解效果 2.2 培养条件对菌群降解BaP的影响 pH值在5~9,随着pH值的增大,BaP降解率呈现出先增大至稳定水平再减少的趋势。YQ-BaP菌群在中性条件下(pH值为6~7)均能较好生长,当初始pH值为7时,菌群的降解效率最高,对20mg/L BaP的去除率达到43.55%。当pH值为8和9时,BaP去除率明显下降。这可能是因为在碱性条件下部分微生物表面点位发生变化从而抑制其生长繁殖,过高的碱性会破坏微生物细胞渗透膜降低了微生物细胞的转运能力。多数芳香烃降解微生物都适合在近中性(pH值为6.5~7.5)的环境下生存。根据这些结果和实际环境考虑,选择pH=7作为后续的试验条件设置。 微生物对温度的适应情况与其组成及种类密切相关,不同菌群最适宜的生长温度也会有所不同。如图4(b)所示,培养14d后YQ-BaP菌群的BaP降解率随着温度升高而增加,当温度为35℃时,BaP降解率达到42.97%,降解效果最好。结果表明低温或高温环境都不利于YQ-BaP菌群对BaP的利用,这可能是因为过低或过高温度会导致菌群的生长繁殖受到抑制,使得降解代谢酶活性削弱或变性失活。该菌群在25~35℃温度范围内的降解效果不一,但可以表现出不同适应能力。 图4 YQ-BaP菌群在不同环境因素下的BaP降解率 pH=7和温度35℃的条件下,研究了BaP不同初始浓度对YQ-BaP菌群降解效果的影响,如图4(c)所示。培养14d后BaP不同初始浓度下降解率从大到小为20mg/L>30mg/L>25mg/L和30mg/L,当BaP浓度为10mg/L时,培养14d后BaP降解率为12.68%。随着BaP浓度的提高,YQ-BaP菌群对BaP的降解效果也随之增加,当BaP浓度为20mg/L时降解率最高,培养14d后可达到46.89%。BaP初始浓度高于20mg/L时,降解率趋于平稳,维持在39.75%左右。YQ-BaP菌群对较高浓度的BaP初始有耐受性。当BaP浓度过低时,菌群正常生长所需的碳源不足,从而影响代谢繁殖和降解效果。当BaP浓度大于20mg/L时对菌群中部分微生物细胞的胁迫作用更强,影响菌群正常的代谢活动。初始底物浓度过高或过低对降解实验效果均会产生影响。 PAHs与重金属都是环境中常见的持久性污染物,金属离子通常同时存在于受PAHs污染水体中。本实验中探究了不同金属离子对菌群降解能力的影响,结果如图4(d)所示。Cd2+、Zn2+和Pb2+对BaP厌氧降解起到抑制作用,培养14d后YQ-BaP菌群对BaP的降解率分别为21.09%、24.81%和19.43%,其中Pb2+的抑制作用最为明显。这可能是因为过高的金属离子浓度对菌群微生物造成毒害,使得降解酶系表达和活性受到影响。而Cu2+和Fe3+对BaP厌氧降解起到促进作用,培养14d后对BaP的降解率分别为64.84%和60.50%。说明YQ-BaP菌群对这两种重金属存在抗性。生物体中多数重要的氧化还原酶受到金属离子的调节,Csonga等认为Fe3+对羟化酶的活性至关重要。海洋沉积物中开发出的PAHs降解菌群DAK11对Mg2+、Mn2+、Pb2+、Fe3+和Cu2+均具有抗性作用,能有效降解Nap、Phe和Pyr等多种PAHs。 2.3 厌氧菌群的降解途径分析 根据各个质谱图的分子离子和主要碎片离子的大小,结合与NIST谱库中已有化合物的质谱图和现有文献报道的代谢产物质谱图比对,共确定到6种具有羧基、羟基或羰基的中间代谢产物,如:4,5-二氢苯并[a]芘、9,10-蒽醌、9,10-二氢蒽、苯甲酸、3-甲基水杨酸和苯酚(图5)。利用本研究所确定的代谢产物和之前从纯菌株培养所确定的BaP降解途径,推测出从厌氧污泥中富集的YQ-BaP菌群厌氧降解BaP的降解途径(图6)。 图5 YQ-BaP菌群代谢产物气质谱图 图6 YQ-BaP菌群对BaP的厌氧降解途径 (采用红色表示的化合物为额外添加的中间产物) 首先,BaP经过加氢作用形成4,5-二氢苯并[a]芘,4,5-二氢苯并[a]芘进一步环裂解转化菲,菲相对BaP而言更容易被生物降解。菲在羟化酶、氢化酶和甲基化酶的共同作用下可转为1、2、3、4-四氢菲再转化为含有两环的萘。而萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,在厌氧产甲烷环境中,发现苯酚可以氧化成苯甲酸,最后生成二氧化碳和甲烷。与之前报道的纯硝酸盐还原条件下BaP降解的代谢途径相比,本实验未发现芘、4,5-二氢芘、1-氨基芘等芘衍生物,这和菌群培养条件及初始环境有关。BaP经过第一个和第二个苯环的加氢形成11,12-二氢苯并[a]芘,随后可添加苯并[a]蒽和1,2,3,4-四氢化苯并[a]蒽等中间代谢产物完善逐步开环转化成蒽的降解途径。随后被氧化为9,10-蒽醌或是还原成9,10-二氢蒽,通过一系列渐进式开环最后产物被产甲烷菌降解利用生成甲烷和二氧化碳。 3 结论 从污泥-秸秆联合厌氧污泥体系中富集出的YQ-BaP菌群,该菌群最主要的菌门为Proteobacteria,约占94.49%,而优势菌属为Pseudomonas和Methyloversatilis。该菌群除能降解苯并[a]芘外,对菲和芘也有良好降解效果。YQ-BaP菌群对10~30mg/L浓度范围内的苯并[a]芘具有耐受性,在温度为35~40℃、pH=7、苯并[a]芘初始浓度为20mg/L时该菌群对苯并[a]芘的降解率可达到46.89%。该菌群可通过羟化、甲基化在厌氧环境下降解苯并[a]芘,首先加氢形成4,5-二氢苯并[a]芘,通过一系列反应环裂解转化菲,转化成二环的萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,最后被生成二氧化碳和甲烷。因此,该菌群在苯并[a]芘污染环境修复中具有很大的应用潜力。 本文作者:易倩文,肖芳,邹晓爽,李江,张云涛,代永恒,王斌,侯立安 作者简介:易倩文,贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),硕士研究生,研究方向为环境生物技术;李江(通信作者),贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),贵州喀斯特环境生态系统教育部野外科学观测研究站,教授,研究方向为有机固废资源化和新污染物治理;侯立安(共同通信作者),中国人民解放军96901部队23分队,中国工程院院士,正高级工程师,研究方向为饮用水安全保障、分散点源生活污水处理和人居环境空气净化等。
 图2 初始样品和YQ-BaP菌群在门水平上的群落结构
图2 初始样品和YQ-BaP菌群在门水平上的群落结构



从污泥-秸秆联合厌氧污泥体系中富集出以BaP为唯一碳源的菌群——YQ-BaP菌群,通过单因素实验研究了不同环境因素对菌群降解能力的影响,采用GC-MS分析苯并[a]芘降解的中间代谢产物。结果表明:该菌群优势菌属为Pseudomonas和Methyloversatilis。该菌群在培养14d后对30mg/L BaP的降解率稳定在38.69%±6.24%,对菲和芘的降解效果更佳。YQ-BaP 菌群在pH=7和35~40℃时表现出较强的降解能力;当BaP初始浓度为20mg/L时,对BaP降解率达到46.89%。GC-MS分析表明,BaP在降解过程中产生菲、蒽和萘等羟化和甲基化代谢产物。研究显示,该菌群具有较强的BaP降解能力,可为多环芳烃污染环境的生物修复提供理论基础和技术支撑。
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是指分子中含有不少于两个苯环,以角状、线状或簇状等方式排列组合构成具有“三致”效应的持久性有机化合物。随着分子结构中苯环数量的增加,PAHs的疏水性、稳定性和毒性增强。作为高分子量PAHs的典型代表,苯并[a]芘具有强疏水性和低水溶性,易在沉积物、土壤和污泥等环境介质中吸附或富集。Shi等发现渭河干流及其支流沉积物中PAHs总致癌性最高可达到138.84mg/kg,其中苯并[a]芘对毒性当量的贡献占44.6%。苯并[a]芘在焦化厂土壤中浓度为110±18.0mg/kg,污染深度高达10m以上,在北京、广州和上海等城市土壤中也发现不同程度的PAHs污染。城市污水处理厂污泥的多环芳烃毒性风险研究中发现苯并[a]芘和二苯并蒽毒性当量最高。由于苯并[a]芘对人类健康和生态系统构成危害,开展苯并[a]芘污染的治理技术研究具有重要意义。 PAHs污染环境的生物修复具有效果好、成本低和无二次污染等特点,是目前最具潜力的PAHs污染治理技术之一。PAHs在好氧环境中易降解,并从中分离富集出诸多好氧降解菌,包括芽孢杆菌、莫拉氏菌、克雷伯氏菌和不动杆菌等。PAHs好氧降解的代谢途径研究较成熟,PAHs通过双加氧酶加氧和脱氢反应生成对应的芳香族二羟基化合物,随后氧化裂解成可生物利用化合物,最后彻底降解。但在厌氧条件下,因微生物代谢缓慢以及缺少氧气作为电子受体使PAHs厌氧降解途径鲜有报道,针对高分子量多环芳烃的厌氧降解过程更是知之甚少。Liang等分离出的假单胞菌JP1在硝酸盐还原条件下可降解菲、荧蒽和苯并[a]芘,培养40d后对10mg/L苯并[a]芘的降解率为30%;而白腐真菌Schizophyllium commune20R-7-F01在培养10d后对50mg/L苯并[a]芘的降解率仅为13.1%。Qin等利用Microbacterium sp.菌株证实了苯并[a]芘的降解过程遵循渐式开环模式。此外,有报道指出苯并[a]芘厌氧生物降解的初始化过程为甲基化或者羧基化,目前关于苯并[a]芘厌氧生物降解途径并未明晰,仅其少数中间代谢产物被证实,例如:二氢苯并[a]芘、芘、菲、萘和蒽等。现有研究主要集中在筛选分离出单菌株降解BaP的代谢产物,有关功能混合菌群降解BaP的化学途径却鲜有报道。此外,环境中多环芳烃降解微生物无法全部进行分离纯化培养且单一菌株对环境要求苛刻,因此可利用宏基因组学来确定富集所得菌群的多样性和功能。目前,关于BaP厌氧降解的研究主要集中于河流沉积物、地下水、深层土壤和海洋沉积物,而对于城市污泥厌氧消化这类典型厌氧环境中多环芳烃生物降解研究较为缺乏,且体系中降解机理研究不够深入。 本研究从污泥-秸秆联合厌氧消化体系中富集出BaP厌氧降解菌群,对降解条件及其性能进行优化研究;采用GC-MS分析鉴别出BaP厌氧降解代谢产物。 1 材料与方法 1.1 培养基 基础培养基:NH4Cl 1.2g、K2HPO4 0.27g、KH2PO4 0.35g、去离子水1 L。 无机盐离子培养基:CaCl2·2H2O 0.1g、MgCl2 0.1g、FeCl2·4H2O 0.02g、Na2S 0.005g、刃天青0.001g、去离子水1L。 微量元素培养基:ZnSO4·7H2O 40mg、MnSO4·4H2O 40mg、NaMoO4·2H2O 8mg、H3BO3 6mg、Ca(NO3)2·4H2O 800mg、FeSO4·7H2O 400mg、CuSO4·5H2O 80mg、去离子水1L。 维生素1溶液:对氨基苯甲酸40mg、生物素10mg、维生素B12 50mg、维生素B3 50mg、维生素B5 100mg、维生素B1 100mg、维生素B6 150mg、去离子水1L。 维生素2溶液:叶酸4mg、核黄素10mg、α-硫辛酸10mg、去离子水1L。 1.2 BaP厌氧降解菌群富集培养 本实验中供试的典型厌氧环境样品来自贵阳市某污水处理厂污泥-秸秆联合厌氧消化体系中的厌氧污泥(即为初始样品)。样品立即被带到实验室并用氮气处理,在使用前置于4℃保存,并在一周内开始实验。 在100mL棕色厌氧瓶中加入5mg/L BaP-乙腈溶液,待乙腈挥发后加入90mL基础培养基并通入氮气10min,随后经121℃高压蒸汽灭菌20min。待灭菌结束后在厌氧手套箱中往瓶内加入灭菌且无氧的无机盐离子培养基(0.1mL)、微量元素培养基(0.1mL)、维生素1和2溶液(0.02mL),补充20mM碳酸氢盐作为电子受体;各种培养基配制均参考前人研究。在培养基中加入污泥-秸秆联合厌氧污泥10mL,控制初始培养pH值为7.2~7.4。接种完成后将厌氧瓶放置于35℃,150r/min摇床进行培养,每隔7d以10%的接种量转接到新鲜液体培养基中,连续转接12次至30mg/L BaP-液体培养基中,定期转接保持菌液活性,并将此厌氧微生物菌群命名为YQ-BaP菌群。 1.3 宏基因测序 将微生物样品送至上海美吉生物医药科技有限公司,采用Fast DNA SPIN Kit for Soil试剂盒(MP bio,CA,USA)抽提DNA。完成抽提后,检验DNA的纯度和浓度,利用1%的琼脂糖胶对DNA的完整性进行检测。检测合格的片段进行剪切(约400bp)和连接,利用PCR扩增进行文库模板的富集,得到最终文库。桥式PCR后,采用IlluminaNovaSeq 6000平台进行高通量测序,随后使用fastp进行质量数据控制,将不同测序深度序列使用Megahit软件进行拼接组装,使用MetaGene对拼接结果中的contigs进行ORF预测,并将其翻译为氨基酸序列。使用CD-HIT软件将所有样品中预测出来的基因序列进行聚类(默认参数为:90%identity,90%coverage),构建非冗余基因集。使用BLASTP将非冗余基因集与NR数据库进行比对(BLAST比对参数设置期望值e-value为1e-5),以获得各个分类学水平上物种在各个样本中的丰度。 1.4 培养条件对菌群降解BaP的影响 本实验研究了pH值、温度、BaP初始浓度和单个金属离子对菌群去除BaP降解率的影响。当BaP浓度为20mg/L时,通过加入0.1M氢氧化钠或0.1M盐酸将培养基的初始pH值调整到5、6、7、8和9。培养温度分别设置为20、25、30、35和40℃,初始BaP浓度为20mg/L。当pH=7,培养温度为30℃时,设置了10、15、20、25和30mg/L的5种初始BaP浓度。分别添加10mg/L Fe2+、Cu2+、Pb2+、Zn2+和Cd2+5种不同金属离子,只含有BaP的样品作为对照组。每个实验组在第7天和第14天采集单个瓶的样品,测定残余BaP,并计算BaP的降解率,以阐明最佳条件。 1.5 菌群降解BaP的代谢产物 本实验采用了气相色谱-质谱联用技术(GC-MS)鉴定出YQ-BaP菌群厌氧降解过程中第1、7和14天BaP的代谢产物,推测了BaP厌氧降解的途径。在溶液中加入等体积的乙酸乙酯,振荡超声20min,循环萃取3次,离心5min(5000r/min),所得的萃取液旋蒸至干,加入20mL甲醇后旋蒸至1mL,使用GC-MS进行全波长扫描。色谱条件:HP-5MS色谱柱(30.0m×250μm,0.25μm),柱温温度为280℃,气化室温度280℃,传输线温度为280℃,载气He,载气流量1.0mL/min,分流比20∶1,进样量为1mL。电子离子源(EI)电压为70eV,温度为230℃,四极杆温度为150℃,扫描模式为Scan,扫描质量范围为33~500u。 1.6 BaP分析测试方法 BaP的提取和含量测定:在溶液中加入等体积的二氯甲烷,振荡30min后,离心5min(5000r/min),收集有机相。重复萃取2次,合并萃取液,加入适量Na2SO4除去萃取液中的水分,旋蒸氮吹至1mL后使用高效液相色谱仪进行测定。测定方法如下:色谱柱采用Athena C18(4.6×150mm,5μm,120A),流动相采用90%乙腈和10%纯净水,柱温为25℃,流速为1.0mL/min,检测波长为295nm。 为保证样品的检测质量,本研究设置了试剂空白和样品空白。试剂空白为不含BaP培养基,样品空白为不含YQ-BaP菌群培养基。回收率为61.66%~90.10%。标准曲线的线性方程为Y=13030X+5038,相关系数R2=0.9998。设计了3个平行实验和一个空白对照组。 2 结果与讨论 2.1 厌氧菌群的富集和群落结构 2.1.1 细菌群落多样性 初始样品和YQ-BaP菌群中细菌群落结构如图1所示,初始样品优势菌门为Actinobacteria(41.23%)、Chloroflexi(20.10%)、Proteobacteria(16.50%)。经过120d富集培养后,优势菌门变为Proteobacteria(94.49%)、Actinobacteria(2.57%)、Gemmatimonadetes(1.16%)。 图1 初始样品和YQ-BaP菌群在属水平上的群落结构 结果表明,Proteobacteria相对丰度增加了77.99%,Actinobacteria和Chloroflexi相对丰度分别减少了38.66%和20.10%。这可能是因为经过BaP富集培养后,微生物之间发生基因突变、复制,由此驯化得到降解PAHs的优势菌群。YQ-BaP菌群中Proteobacteria占绝对优势,在BaP的降解过程中发挥了重要作用。Proteobacteria在其他受PAHs污染的环境中也被发现是优势菌门。Sazykin等在俄罗斯热电厂附近受污染的土壤中分离出的6株PAHs可培养降解菌株均隶属于Actinobacteria。Martirani-Von Abercron等以硝酸盐为电子受体和PAHs为唯一碳源在受污染沉积物中所富集的菌群以Parcubacteria为优势菌门,而Proteobacteria仅占比15%。 为进一步明确菌群的类型,本研究在属分类水平下分析微生物多样性。与初始样品的微生物多样性相比,细菌群落组成发生了显著性变化。如图2所示,在初始样品中占比低于1%的菌属成为优势菌属,而原有的Candidatus_Microthrix、Candida⁃tus_Promineofilum和Anaerolinea逐渐减少或消失。YQ-BaP菌群主要包含Pseudomonas(41.30%)、Methyloversatilis(21.06%)、Ciceribacter(5.86%)和Alicycliphilus(5.53%)。Pseudomonas和Thauera的一些物种属于兼性菌,在厌氧条件下降解碳氢化合物。多数已成功分离的Nap好/厌氧降解菌株也属于Pseudomonas菌属。Methyloversatilis菌属曾被多次报道对PAHs产生降解作用并与PAHs的浓度呈现正相关。此外,Smalley等指出Methyloversatilis discipulorum的基因组显示存在与PAHs降解相关的多种基因,如编码环羟基化双加氧酶和儿茶酚2,3双加氧酶。其他占比不高的菌属,如Alicycliphilus、Thauera、Sphingomonas和Rhodococcus也常被报道可以降解碳氢化合物或多环芳烃。从海洋沉积物中富集培养出的BaP降解菌群优势菌属为Stenotrophomonas、Sulfurovum和Desulfosarcina,而YQ-BaP菌群的优势菌属是Pseudomonas、Methyloversatilis和Ciceribacter。 2.1.2 厌氧菌群对PAHs的降解率 该菌群除了降解BaP外,对菲和芘具有不同程度的降解,表现出一定的普适性。从图3可以看出,YQ-BaP菌群在7d后对30mg/L BaP和菲的降解率为38.69%和47.78%,而对芘的降解效果明显,培养7d后对30mg/L芘的降解率为38.57%,培养14d后降解率达到了79.59%。一般情况下,PAHs的分子量越大,微生物越难降解,菲和芘的分子量更小,水溶解度更高。本研究中,该菌群芘降解效果最好,可能是BaP厌氧降解过程会产生菲和芘这两种中间产物,厌氧降解菌群之间存在相似性,微生物生成和分泌这两种PAHs降解酶系。从海底2.5km处厌氧沉积物筛选出的白腐真菌Schizophyllium commune 20R-7-F01能对菲、芘和BaP都存在降解效果,但降解率不一,培养10d后降解率分别为25%、18%和13%。王慧等分离出的Thalssospira sp.strain TSL5-2,可降解菲、芘、荧蒽(初始质量浓度为20mg/L)和苯并蒽(8mg/L),但不能降解BaP。本研究富集的YQ-BaP菌群,可以降解3~5环的PAHs,尤其对芘的降解效果最好,存在PAHs污染修复应用潜力。 图3 YQ-BaP菌群对PAHs降解效果 2.2 培养条件对菌群降解BaP的影响 pH值在5~9,随着pH值的增大,BaP降解率呈现出先增大至稳定水平再减少的趋势。YQ-BaP菌群在中性条件下(pH值为6~7)均能较好生长,当初始pH值为7时,菌群的降解效率最高,对20mg/L BaP的去除率达到43.55%。当pH值为8和9时,BaP去除率明显下降。这可能是因为在碱性条件下部分微生物表面点位发生变化从而抑制其生长繁殖,过高的碱性会破坏微生物细胞渗透膜降低了微生物细胞的转运能力。多数芳香烃降解微生物都适合在近中性(pH值为6.5~7.5)的环境下生存。根据这些结果和实际环境考虑,选择pH=7作为后续的试验条件设置。 微生物对温度的适应情况与其组成及种类密切相关,不同菌群最适宜的生长温度也会有所不同。如图4(b)所示,培养14d后YQ-BaP菌群的BaP降解率随着温度升高而增加,当温度为35℃时,BaP降解率达到42.97%,降解效果最好。结果表明低温或高温环境都不利于YQ-BaP菌群对BaP的利用,这可能是因为过低或过高温度会导致菌群的生长繁殖受到抑制,使得降解代谢酶活性削弱或变性失活。该菌群在25~35℃温度范围内的降解效果不一,但可以表现出不同适应能力。 图4 YQ-BaP菌群在不同环境因素下的BaP降解率 pH=7和温度35℃的条件下,研究了BaP不同初始浓度对YQ-BaP菌群降解效果的影响,如图4(c)所示。培养14d后BaP不同初始浓度下降解率从大到小为20mg/L>30mg/L>25mg/L和30mg/L,当BaP浓度为10mg/L时,培养14d后BaP降解率为12.68%。随着BaP浓度的提高,YQ-BaP菌群对BaP的降解效果也随之增加,当BaP浓度为20mg/L时降解率最高,培养14d后可达到46.89%。BaP初始浓度高于20mg/L时,降解率趋于平稳,维持在39.75%左右。YQ-BaP菌群对较高浓度的BaP初始有耐受性。当BaP浓度过低时,菌群正常生长所需的碳源不足,从而影响代谢繁殖和降解效果。当BaP浓度大于20mg/L时对菌群中部分微生物细胞的胁迫作用更强,影响菌群正常的代谢活动。初始底物浓度过高或过低对降解实验效果均会产生影响。 PAHs与重金属都是环境中常见的持久性污染物,金属离子通常同时存在于受PAHs污染水体中。本实验中探究了不同金属离子对菌群降解能力的影响,结果如图4(d)所示。Cd2+、Zn2+和Pb2+对BaP厌氧降解起到抑制作用,培养14d后YQ-BaP菌群对BaP的降解率分别为21.09%、24.81%和19.43%,其中Pb2+的抑制作用最为明显。这可能是因为过高的金属离子浓度对菌群微生物造成毒害,使得降解酶系表达和活性受到影响。而Cu2+和Fe3+对BaP厌氧降解起到促进作用,培养14d后对BaP的降解率分别为64.84%和60.50%。说明YQ-BaP菌群对这两种重金属存在抗性。生物体中多数重要的氧化还原酶受到金属离子的调节,Csonga等认为Fe3+对羟化酶的活性至关重要。海洋沉积物中开发出的PAHs降解菌群DAK11对Mg2+、Mn2+、Pb2+、Fe3+和Cu2+均具有抗性作用,能有效降解Nap、Phe和Pyr等多种PAHs。 2.3 厌氧菌群的降解途径分析 根据各个质谱图的分子离子和主要碎片离子的大小,结合与NIST谱库中已有化合物的质谱图和现有文献报道的代谢产物质谱图比对,共确定到6种具有羧基、羟基或羰基的中间代谢产物,如:4,5-二氢苯并[a]芘、9,10-蒽醌、9,10-二氢蒽、苯甲酸、3-甲基水杨酸和苯酚(图5)。利用本研究所确定的代谢产物和之前从纯菌株培养所确定的BaP降解途径,推测出从厌氧污泥中富集的YQ-BaP菌群厌氧降解BaP的降解途径(图6)。 图5 YQ-BaP菌群代谢产物气质谱图 图6 YQ-BaP菌群对BaP的厌氧降解途径 (采用红色表示的化合物为额外添加的中间产物) 首先,BaP经过加氢作用形成4,5-二氢苯并[a]芘,4,5-二氢苯并[a]芘进一步环裂解转化菲,菲相对BaP而言更容易被生物降解。菲在羟化酶、氢化酶和甲基化酶的共同作用下可转为1、2、3、4-四氢菲再转化为含有两环的萘。而萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,在厌氧产甲烷环境中,发现苯酚可以氧化成苯甲酸,最后生成二氧化碳和甲烷。与之前报道的纯硝酸盐还原条件下BaP降解的代谢途径相比,本实验未发现芘、4,5-二氢芘、1-氨基芘等芘衍生物,这和菌群培养条件及初始环境有关。BaP经过第一个和第二个苯环的加氢形成11,12-二氢苯并[a]芘,随后可添加苯并[a]蒽和1,2,3,4-四氢化苯并[a]蒽等中间代谢产物完善逐步开环转化成蒽的降解途径。随后被氧化为9,10-蒽醌或是还原成9,10-二氢蒽,通过一系列渐进式开环最后产物被产甲烷菌降解利用生成甲烷和二氧化碳。 3 结论 从污泥-秸秆联合厌氧污泥体系中富集出的YQ-BaP菌群,该菌群最主要的菌门为Proteobacteria,约占94.49%,而优势菌属为Pseudomonas和Methyloversatilis。该菌群除能降解苯并[a]芘外,对菲和芘也有良好降解效果。YQ-BaP菌群对10~30mg/L浓度范围内的苯并[a]芘具有耐受性,在温度为35~40℃、pH=7、苯并[a]芘初始浓度为20mg/L时该菌群对苯并[a]芘的降解率可达到46.89%。该菌群可通过羟化、甲基化在厌氧环境下降解苯并[a]芘,首先加氢形成4,5-二氢苯并[a]芘,通过一系列反应环裂解转化菲,转化成二环的萘通过羧基化、氧化和脱氢作用形成苯酚、苯甲酸和3-甲基水杨酸,最后被生成二氧化碳和甲烷。因此,该菌群在苯并[a]芘污染环境修复中具有很大的应用潜力。 本文作者:易倩文,肖芳,邹晓爽,李江,张云涛,代永恒,王斌,侯立安 作者简介:易倩文,贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),硕士研究生,研究方向为环境生物技术;李江(通信作者),贵州大学资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室(贵州大学),贵州喀斯特环境生态系统教育部野外科学观测研究站,教授,研究方向为有机固废资源化和新污染物治理;侯立安(共同通信作者),中国人民解放军96901部队23分队,中国工程院院士,正高级工程师,研究方向为饮用水安全保障、分散点源生活污水处理和人居环境空气净化等。
 图2 初始样品和YQ-BaP菌群在门水平上的群落结构
图2 初始样品和YQ-BaP菌群在门水平上的群落结构






